Cette page est en Bêta. Pour modifier ce cours, cliquer ici.
Chapitre 1 : Généralités sur les solutions aqueuses
I - Rappels
A - Définitions
Soluté : Espèce chimique dissoute.
Solution : Une solution est un mélange homogène constituée d'une seule phase résultant de la dissolution d'un ou plusieurs solutés.
Solvant : Espèce chimique en capacité de dissoudre un soluté pour former une solution.
Conductivité : La conductivité d'une solution ionique correspond à sa capacité à conduire le courant. Elle dépend de la nature des ions, de leur concentration et de la température. On la mesure en S/m.
⚠️ Ne pas confondre conductance et conductivité ! La conductance dépend d'une électrode et de sa taille !
B - Formules
Formule liant la concentration molaire (C en mol/L) avec la quantité de matière (n en mol) et le volume (V en L) :
Formule liant la concentration massique ( en g/L) avec la masse (m en g) et le volume (V en L) :
Formule liant la concentration massique ( en g/L) avec la concentration molaire (C en mol/L) et la masse molaire (M en g/mol) :
Equation de la dilution :
Avec :
- : la concentration de la solution finale (fille) en mol/L ou g/L
- : le volume de la solution finale en L
- : la concentration de la solution initiale (mère) en mol/L ou g/L
- : le volume de la solution initiale en L
Remarque : Pour les concentrations, il est important de tout mettre en g/L opu tout mettre en mol/L mais de ne pas faire d'entre deux.
Formule de la conductance (en Siemens) :
Avec :
- G : la conductance (S)
- S : la surface des électrodes (m)
- L : la distance entre les plaques (m)
- : la conductivité de la solution (en S/m)
Formule de la conductivité molaire ionique :
Avec :
- : la conductivité de la solution (en S/m)
- : conductivité molaire limite de l'ion i en
- : Concentration molaire de l'ion i en
table de conductivité molaire ioniques limites :
Cations
| Nom | Symbole | |
|---|---|---|
| oxonium | ||
| potassium | ||
| sodium | ||
| ammonium | ||
| lithium | ||
| césium | ||
| rubidium | ||
| argent |
Anions
| Nom | Symbole | |
|---|---|---|
| hydroxyde | ||
| bromure | ||
| iodure | ||
| chlorure | ||
| fluorure | ||
| nitrate | ||
| éthanoate | ||
| benzoate |
II - Les propriétés de l'eau
A - Généralités
La molécule d'eau est constituée d'un atome d'oxygène et de deux atomes d'hydrogène. La molécule est coudée et on dit qu'elle est polaire. L'eau est un solvant polaire c'est-à-dire qu'elle solubilise des molécules polaires mais pas des molécules apolaires.
A l'inverse, le cyclohexane est un solvant apolaire, c'est-à-dire qu'il est en capacité de solubiliser des molécules apolaires mais pas des molécules polaires.
Exemple de l'eau et de l'huile

B. L'autoprotolyse de l'eau
L'eau a une conductivité très faible, mais non nulle. Cela signifie qu'elle contient des ions.
Equation d'autoprotolyse de l'eau :
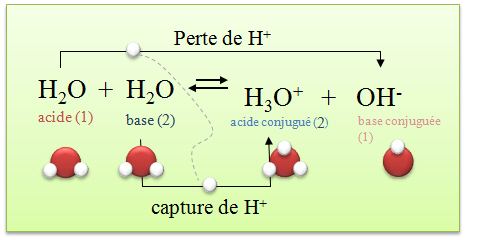
Remarque : Dans l'eau pure,
C. Les étapes de dissolution dans l'eau d'un soluté
| Nom | Définition | Exemple |
|---|---|---|
| Ionisation | Formation de paires d'ions | |
| Dissociation | Séparation des charges dans l'eau | |
| Hydratation | Les ions sont entourés de molécules d'eau |
Dans certains cas, notamment pour les solides ionique, la phase d'ionisation est inutile car les éléments le sont déjà.
Exemples :
| Molécule dissoute | Etapes | Equation de réaction |
|---|---|---|
| Solide ionique : | Dissociation + hydratation | |
| Soluté moléculaire : saccharose | Dispersation des molécules par hydratation des molécules | |
| Soluté moléculaire : | Ionisation + Dissociation + Hydratation |
III - Electrolytes forts et faibles
Tous les éléments qui se dissolvent dans l'eau en donnant des ions sont appelés électrolyte.
A. Electrolytes forts
Ils se transforment totalement en ions dans l'eau.
On peut citer NaCl, HCl, NaOH.
B. Electrolytes faibles
Pour certains éléments, l'ionisation ne peut être que partielle.
Certains solides peuvent aussi se dissoudre que de manière partielle.
On parle alors d'électrolyte faible.
Notion de coefficient d'ionisation : Le coefficient d'ionisation, compris entre 0 et 1 peut etre calculé de la manière suivante :